Когато малък кръвоносен съд в организма е прерязан или увреден, започва серия от реакции, които водят до спиране на кръвотечението (хемостаза). Това запушва увредения участък и предпазва от по-голяма кръвозагуба. Първоначално се получава констрикция на съда и образуване на временна хемостатична запушалка от тромбоцити, което е резултат от свързването на тромбоцитите към колагена. Тромбоцитите имат върху мембраната си рецептори за колагена и се свърват навсякъде където има оголен колаген – той е белег за увреждане на съдовата стена с потенциална опасност от кръвозагуба. Впоследствие тромбоцитната запушалка се превръща в окончателен съсирек. Констрикцията на една увредена артериола или малка артерия може да бъде значителна, така че луменът й да се запуши. Свиването е резултат от действието на серотонин и други вазоконстриктори, освободени от тромбоцитите при тяхната адхезия върху увредената съдова стена; допълнителна роля играе самото механично дразнене от увреждащия агент – то също води до рефлекторно свиване на съда. Има експериментални данни, според които единствено чрез вазоконстрикция е възможно спиране на кръвотечение дори от съд с калибъра на радиалната артерия, но само при напречно срязване на съда. При лонгитудинално срязване или разкъсване вазоконстрикция не настъпва и кървенето е много по-обилно и продължително. При кръвосъсирването участват 13 фактора, които при нормални условия циркулират в кръвната плазма в неактивна форма.
Описани са следните фактори на кръвосъсирването:
Фактор 1 - Фибриноген
Фактор 2 - Протромбин
Фактор 3 - Тъканна тромбокиназа
Фактор 4 - Калциеви йони
Фактор 5 - Проакцелерин
Фактор 6 - Тромбоцитен фосфолипид
Фактор 7 - Проконвертин
Фактор 8 - Антихемофилен глобулин
Фактор 9 - Christmas фактор
Фактор 10 - Фактор на Стюарт - Проуер
Фактор 11 - Плазмен тромбопластинов акцелератор
Фактор 12 - Фактор на Хагеман
Фактор 13 - Фактор на Леки - Лоранд
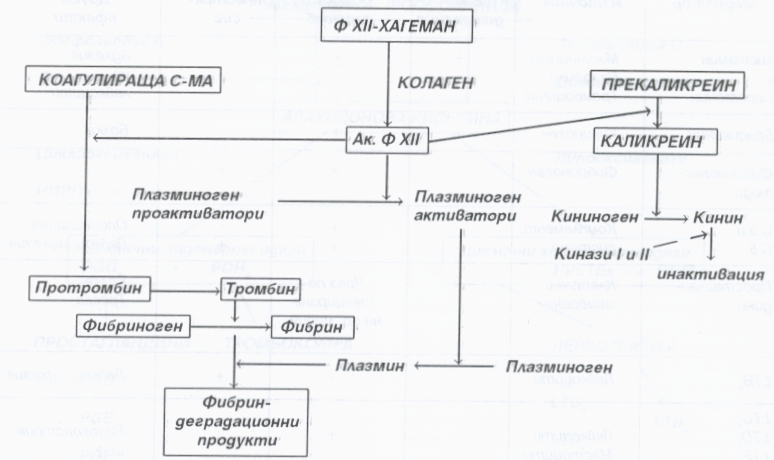
Във временната запушалка тромбоцитите са свързани с хлабава агрегация и превръщането им в окончателен съсирек става посредством фибрин. Фибринът играе ролята на скелет на кръвния съсирек. Образува се в резултат от каскада от реакции, при които неактивни ензими се активират и последователно активират други ензими. Основната реакция е превръщането на разтворимия плазмен белтък фибриноген в неразтворим фибрин. Фибринът първоначално е хлабава мрежа от преплитащи се нишки. Постепенно той се превръща обаче в плътен и здрав агрегат посредством образуването на напречни ковалентни връзки. Тази реакция се катализира от активирания фактор XIII и изисква Са – йони. Превръщането на фибриногена във фибрин се катализира от тромбин. Тромбинът е серинова протеаза, която се образува от своя циркулиращ прекурсор протромбин под действието на активния фактор X. Фактор X може да бъде активиран от реакции, протичащи в две системи - вътрешна и външна. Началната реакция във вътрешната система е превръщането на неактивния фактор XII в активен. Реакцията in vivo се отключва когато кръвта е в допир с колагеновите влакна, подлежащи под ендотела в кръвоносните съдове. Чрез поредица от реакции се ативира фактор X, като за пълната му активация са необходими фосфолипиди от агрегираните тромбоцити и калциеви йони. Външната система се активира от освобождаването на тъканен тромбопластин. Това е белтъчно – фосфолипидна смес, която се образува при тъканно увреждане и активира фактор VII. Крайният резултат отново е превръщането на фактор X от неактивен в активен.

Схема на каскадата на кръвосъсирването и фибринолизата
www.dentalimplants.bg www.endodontia.bg Зъб Система на комплемента Ретиниран зъб
Действието на съсирващите механизми in vivo се балансира посредством лимитиращи реакции. Съществува баланс между много комплексни, взаимосвързани системи, като по този начин се предотвратяват и хеморагиите, и спонтанните вътресъдови съсирвания. В организма има изградена противосъсирваща система, която ограничава кръвосъсирването в оптимални за конкретната ситуация граници. Към тази система спадат различни видове биологично – активни вещества. Простациклинът например има антиагрегиращ ефект – той противодейства на тромбоцит – агрегиращия ефект на тромбоксан А2. Чрез баланса между действието на тези два белтъка е възможно да се образуват съсиреци върху увредени участъци от съдовата стена и в същото време да се поддържа луменът на съда проходим – не се нарушава кръвоснабдяването на съответната област. Антитромбин 3 пък е циркулиращ протеазен инхибитор, който се свързва към сериновите протеази в коагулационната система, блокирайки тяхната активност като съсирващи фактори. Това свързване се улеснява от хепарина, естествено срещащ се антикоагулант, кйто представлява смес от сулфатирани полизахариди с молекулни тегла от 15000 до 18000. Инхибира се действието на активните фактори IX, X, XI, XII.
Ендотелът на кръвоносните съдове също има активна роля в предотвратяването на разпространението на съсиреците вътре в съдовете. Всички ендотелни клетки с изключение на тези в церебралната микроциркулация произвеждат тромбомодулин, който се свързва с тромбина. В резултат на това тромбинът от прокоагулант се превръща в антикоагулант и активира протеин С. Последният е вещество със силно антикоагулантно действие – инактивира фактори V и VII на кръвосъсирването и в същото време инактивира инхибитора на тъканния плазминогенен активатор, при което се образува много по-голямо количество плазмин от циркулиращия плазминоген. Действието на белтък С се улеснява от спомагателната субстанция белтък S.
Плазминът (фибринолизин) е активният компонент на фибринолитичната система. Той разгражда фибрина и фибриногена. При това се образуват фибринови разпадни продукти, които инхибират тромбина – по този начин се ограничава и образуването на нов фибрин. Човешкият плазмин се състои от 560 – аминокиселинна тежка верига и 241 – аминокиселинна лека верига, а плазминогенът – от една белтъчна верига от 801 аминокиселинни остатъка. Под действието на тъканния плазмонигенен активатор (ТПА) се разкъсва връзката между аргинин 560 и валин 561 в молекулата на плазминогена, при което се получават две вериги (тежката и леката на вече активирания по този начин плазмин). Съществуващите преди това дисулфидни мостове се запазват и двете вериги продължават да бъдат свързани. Човешкият ТПА сега се произвежда чрез рекомбинантни ДНК – техники и се използва за лечение на острия миокареден инфаркт – лизира образуваните съсиреци в коронарните артерии.
Витамин К е вещество с важно значение за кръвосъсирването. Той е необходим кофактор на ензима, катализиращ превръщането на глутаматните остатъци в гама – карбоксиглутаминова киселина. Шест от факторите на кръвосъсирването изискват тази киселина при образуването си в черния дроб и съответно не могат да се образуват при липса на витамин К в храната или при чревна дисбактериоза, тъй като витаминът се произвежда и от чревната флора. Тези белтъци са факторите и белтък С и белтък Кумариновите производни (дикумарол, уорфарин) инхибират действието на витамин К и затова имат противосъсирващ ефект – използват се за предотвратяването на тромбозирането например при пациенти с клапни протези.
По Бюркер времето на кръвосъсирване у човека е средно 5 – 6 минути (до начало на образуване на първите нишки фибрин). Окончателното кръвосъсирване е в рамките на 5 – 10 минути. При редица заболявания се нарушава процесът на взаимодействие между съсирващата и фибринолитичната система на кръвта. Най-общо нарушенията могат да предизвикат забавено или ускорено кръвосъсирване. Ускореното кръвосъсирване е опасно патологично състояние – може да се стигне до образуване на тромби с летален изход. Среща се при недостиг на естествени антикоагуланти (хепарин, антитромбин), също при алкохолна интоксикация – инхибира се фибринолизата. Временно ускоряване на съсирването се наблюдава при възбуждане на симпатико – адреналната система (при болка, страх, оперативна травма, стресови състояния). Към образуване на тромби са предразположени болни от атеросклероза, хипертония, ревматизъм и затлъстяване, също продължително обездвижени пациенти. Намалена фибринолиза се наблюдава при прием на орални антиконцепционни средства и физиологично към края на бременноста.
В областта на оралната и лицево – челюстната хирургия обаче много по-голямо значение имат нарушенията в хемокоагулацията, които са свързани със забавено кръвосъсирване, тъй като при пациенти с такива заболявания има голяма опасност от тежки, трудни за овладяване кръвоизливи. След всякa eкстракця на зъб или каквато и да е хирургична интервенция е нормално да се наблюдава слабо кръвотечениe. То има капилярен xapaктep и спира спонтанно и окончателно за няколкo минути, като алвеолата на eкстрахирания зъб се изпълва с кръвен коагулум. За кръвоизлив катo усложнение след eкстракция може да се мисли тогава, когатo кървенето не спира след изтичането на нормалното за това време (3 – 8 мин.) или когатo то се възобновява след различен период от време при нормално протекла хемокоагулация. Taковa усложнение се дефинира катo haemorrhagio post extractionem. Тя може да бъде ранна (първична) – проявява се непосредствено след eкстракциятa или къснa (вторична) – проявява се часове, а понякога и дни след eкстракцията на зъб. Последната е сравнително по-рядко наблюдавана и задължително насочва вниманието за наличието на хеморагична диатеза от рода на коагулопатиите.
Причините за следекстракционните кръвоизливи могат да бъдат местни или общи. Причините от общ xapaктep се наблюдават при различните хеморагични диатези. Тяхното многообразие определя трудностите при диагностиката им, а това изисквa и тясна колабopaция със съответните специалисти. При всякo съмнение за наличие на хеморагична диатеза и анамнестични данни или клинични прояви е задължително да се изясни елементарния хемостазен статус. Той включва времето на кървене, времето на съсирване, броя на тромбоцитите, протромбиновото време и xeматокритa. По-нататък диагностиката може да продължи в лабораториите по хематология с изследване на разширения хематостазен статус (функционални изследвания и имунологични методи), катo в съображение влизат:
Тестове за тромбоцитна агрегация
Тестове за тромбоцитна адхезия
Реакция на секреция и прокоагулантни качествa на тромбоцитите.
Определяне на фактора на ф. Вилебранд
Антитромбоцитни антитела
Кефалин – каолиновo време
Тромбиново време
Комплексно определяне на копагулационните фактори
Количествено определяне на фибриногена
Изследване на фибринолизата и инхибиторите на кoагулацията и фибринолизата
Дoкaзвaнeтo на вида на хеморагичната диатеза е от решаващо значение за поведението по време и след извършването на какватo и да е инвазивна интервенция. Най-честите хеморагични диатези са тромбоцитопатиите, тромбоцитопениите, вазопатии и коагулопатиите. Тромбоцитопениите са голяма и разнородна група заболявания с различна етиология и патогенеза. Броят на тромбоцитите е под нормата (150 х 109/л.). Срещат се наследствени тробмоцитопении, тромбоцитопении в резултат от намалена продукция, от повишена деструкция и от повишена консумация и секвестрация на тромбоцитите.
Към наследствените тромбоцитопении спада s.Wiscott – Aldrich. Той се развива като комбиниран дефект на клетъчния имунитет, синтеза на IgM и функцията на тромбоцитите. Намаленото количество на IgM затруднява защитата срещу бактериалните инфекции, а тромбоцитите се аглутинират и разрушават лесно. При хиперспленизма има консумативен (поради натрупване в слезката – понякога до 90 % от тромбоцитите се намират там) механизъм на тромбоцитопения. До хиперспленизъм водят различни видове заболявания – портална хипертония, конгестивна спленомегалия, лимфоми, миелофиброза, миелолевкоза, туберкулоза. При болестта на Moschcowitz има увреждане на ендотела в резултат на автоимунен процес в малките кръвоносни съдове. Отделят се големи мултимери на фактора на ф. Вилебранд, които активират хемостазата. Тромбоцитите се агрегират в мултиплени микросъдови тромбози – в резултат на това се развива тромбоцитопения. Намаленият брой на тромбоцитите при намалена продукция се обуславя от увреждане на родоначалните мегакариоцити в костния мозък от различни патологични процеси, като най-често се засягат и трите кръвни реда и много по-рядко само мегакариопоезата. Най-чести причини са остра левкоза, миелобластен стадий на миелолевкоза, вродена костномозъчна хипо- и аплазия, лъчева болест, полихимиотерапия. Описани са тромбоцитопении при свръхчувствителност към някои вещества – метални соли, сулфонамиди, диуретици, антибиотици, цитостатици, алкохол, транквилизатори. Медикаментите действат най-често чрез имунно свързване на антитяло с рецептори на мегакариоцита. По-рядко се наблюдава неимунно директно увреждане с токсичен механизъм на тромбоцитите в периферията или чрез увреждане на матурацията на мегакариоцитите.
Всички описани дотук заболявания са с разнообразна етиопатогенеза, но със сходна клинична картина: среща се хеморагичен синдром по кожата, лигавиците и вътрешните органи. Наблюдават се кожни и лигавични хеморагии : петехии и екхимози с дифузно разположение. Чести са епистаксисите, гингиворагиите, мено- и метрорагиите, хематурията; понякога при по-тежко протичане има гастроинтестинални прояви (хематемеза, мелена) и ретинни кръвоизливи. Съпътстващи синдроми са анемичният и септичният, най-вече при апластичните тромбоцитопении. Това налага при пациент с описаните симптоми да се проведе консултация с интернист и рутинно кръвно изследване. Открива се намален брой на тромбоцитите в периферната кръв, увеличено време на кървене и нормално или леко увеличено време на съсирване. При липса на подходяща подготовка веднага след манипулацията започва профузно кървене, което се овладява трудно. Намаленият брой тромбоцити не позволява образуването на т. нар. бял тромб, който спира кървенето от съдове предимно с малък калибър. Това забавя до известна степен и образуването на фибриновия съсирек, който осъществява окончателното съсирване и спирането на кървенето. При костномозъчна хипо- или аплазия се прилага лечение с анаболни хормони, андрогени, кортикостероиди, имуностимулатори. Хеморагичният синдром се повлиява добре от вливане на цялостна прясна кръв или тромбоцитен концентрат (1 Е концентрат съдържа 50.109 тромбоцита). Тромбоцитни вливания се правят при умерени кръвоизливи в доза 1Е/15 кг. тегло и при тежки – 2 – 2.5Е / 15 кг. При автоимунните тромбоцитопении средство на избор са кортикостероидите в дози 1.5 – 2 мг/кг телесно тегло. Спленектомията е радикално решение при тези заболявания. При болни с резистентност към кортикостероидите и спленектомията се прилагат имуносупресори – веднъж седмично винкристин по 2 мг. за 4 – 6 седмици или имуран 2 – 3 мг/кг дневно за 3 – 5 месеца. При лекарствени имунни тромбоцитопении незабавно се спира приемът на подозираното лекарство и се търси алтернативна възможност за лечение на съответното заболяване. Обикновено това е достатъчно и броят на тромбоцитите се нормализира.
При тромбоцитопатиите броят на тромбоцитите е нормален или леко намален, но се установява нарушение на функцията им – адхезия и агрегация. Тук спадат различни видове вродени заболявания:
Болест на von Willebrand – Jurgens – аномална структура на фактора на von Willebrand, поради което се нарушава тромбоцитната адхезия към разкъсаните при травма кръвоносни съдове
Болест на Glanzmann – дефицит на мембранните протеини глюкопептид II B и III A, които са рецептори за фибриногена, разположени върху тромбоцитната мембрана. При липса на тези протеини се нарушават адхезията и агрегацията на тромбоцитите
Болест на Bernard – Soulier – липса по рождение на мембрания глюкопротеин I В – той е рецептор за фактора на von Willebrand и при неговото отсъствие също се нарушават агрегацията и адхезията на тромбоцитите
SPD – синдром. Това е група от вродени интратромбоцитни ефекти на биохимично ниво, в резултат на които е смутена функцията на тромбоцитите
Тромбоцитопении поради нарушена обмяна на простагландините. Тук има вродена липса на някои ензими, в резултат на което се подтиска образуването на тромбоксан А2 – важен медиатор на тромбоцитната агрегация и адхезия. Подобен ефект се постига и с приема на аспирин като антикоагулантно средство.
При всички тези състояния клиничната картина е сходна с тази на тромбоцитопениите – кожни и лигавични хеморагии, увеличено време на кървене и опасност от тежки, профузни кръвоизливи при инвазивни манипулации. Лечението е базирано на принципа на заместващата терапия – вливат се прясна кръв при анемичен синдром или само тромбоцитна маса.
Срещат се и придобити тромбоцитопатии. Те са хетерогенна група патологични състояния, които съпътстват различни заболявания: бластна левкоза, диспротеинемия, уремичен синдром, автоимунни заболявания, прием на антикоагуланти. В по-голямата част от случаите хеморагиите са слабо изразени, но на фона на основното заболяване понякога се стига до взаимно утежняване и се развива тежък хеморагичен синдром. Лечението е насочено преди всичко към основното заболяване, но при тежко протичане се налага също заместващо лечение. При такива случаи хирургичните манипулации се извършват с особено внимание и след необходимите косултации със съответните специалисти.
Вазопатиите се характеризират с повишена чупливост и пропускливост на съдовете и се доказват предимно клинично, тъй като лабораторните показатели на кръвосъсирването обикновено са в границите на нормата. По-често се срещат наследствените вазопатии:
Болест на Rendu – Osler – Weber – характеризира се с липса на еластин и колаген в малките съдове, което с течение на времето води до изтъняване на съдовата стена. Образуват се ангиектатични нодулки в определени участъци, чиято стена е съставена от ендотелни клетки. При минимална травма, а понякога и спонтанно, се получава руптура и обилна и упорита хеморагия. Лечението е симптоматично – термо- или електрокоагулация на телеангиектазиите, съдосвиващи и съдоукрепващи препарати
Синдром на Ehlers – Dahnlos. При това заболяване пациентите имат типичен хабитус – високи, слаби, със силно увеличена подвижност на ставите, с по-дълги крайници. Тук също се срещат телеангиектазии: по кожата на лицето, ръцете, лигавицата на устната кухина и носа. При по-тежко протичане се наблюдават хеморагии по кожата, епистаксиси, гингиворагии, хематурия, хематемеза и мелена. При хирургични манипулации често се получават тежки кръвоизливи, затова се изисква повишено внимание от страна на стоматолога
При придобитите вазопатии клиничната картина е сходна с тази при вродените. Най-честите вазопатии са:
Болест на Schoenlein – Hennoch (идиопатична тромбоцитопенична пурпура, капиляротоксикоза). В резултат на чести респираторни инфекции, употреба на някои видове медикаменти и храни и т.н. се получават циркулиращи имунни комплекси срещу ендотелните клетки. Развива се асептичен васкулит, който засяга малките кръвоносни съдове, нарушава се целостта на съдовата стена и се проявяват кръвоизливи по кожата и лигавиците. Налице са общи прояви – фебрилитет, адинамия, болки по ставите и корема. Пурпурата има уртикарен характер със сърбеж, зачервяване и оточност на кожата. Впоследствие се явяват надигнати кръвоизливни образувания, често с некроза или мехурче в средата. При абдоминалната форма има обилна мелена и хематемеза с коликообразни болки и повишена температура. Бъбречната форма протича с хематурия и протеинурия. Лечението е комплексно – назначават се антиалергични препарати, противовъзпалителни и съдоукрепващи средства. Прилагат се хепарин и имуносупресори
Скорбут. Тук е нарушен синтезът на колаген поради липса на аскорбинова киселина – най-често в резултат на хранителен дефицит. Налице са тежки гингиворагии и разграждане на тъканите на пародонта. В днешно време скорбут се наблюдава много рядко, но в миналото се е откривал често при мореплаватели, полярни изследователи и изобщо при хора на еднообразен хранителен режим. Лечението е с големи дози витамин С и общоукрепващи средства
Сенилна пурпура – поради дегенеративни промени в колагена е налице намалена устойчивост на съдовата стена спрямо механични увреждания и трудно зарастване на рани след хирургични интервенции. Лечението е със съдоукрепващи средства
Медикаментозни увреждания на съдовете – при прием на индометацин, хинидин, резерпин, сулфонамиди, хинин, естрогени, фуроземид, дигоксин, кумаринови антикоагуланти, хлорамфеникол, L – метилдопа
Увреждания на съдовете при инфекциозни заболявания, лимфоми и миеломи. При всички изброени дотук заболявания съществува опасност от тежки хеморагии при всички хирургични намеси. Ето защо при липса на спешност се налага корекция на хемостазните показатели от съответния специалист. Спешните манипулации пък е необходимо да се извършват само в специализирани лечебни заведения под контрола на хематолог и реаниматор.
Коагулопатиите също се делят на вродени и придобити. Тук влизат голям брой патологични състояния с разнообразна етиология и патогенеза. При вродените коагулопатии най-честа е хемофилията. При нея има вроден дефицит на фактор VIII (хемофилия А) или фактор IX (хемофилия В) на кръвосъсирването. Тежестта на клиничните прояви зависи много от тежестта на дефицита. Характерно е силно удълженото време на съсирване и кефалин – каолиновото време дори до безкрайност. Времето на кървене е нормално. Според типа хемофилия се намира дефицит на фактор VIII или IХ под 30 % от нормата. Най-често е под 1 %, понеже преобладават тежките форми. Клиничната картина се характеризира с кръвоизливи след минимални травми, понякога няколко дни след травмата. Срещат се и вътретъканни кръвоизливи, хемартрози, епистаксиси, гастроинтестинални кръвоизливи. Кръвоизливите в ЦНС са рядка, но опасна проява на хемофилията. Хеморагиите след екстракция на зъби също са характерни. Те започват няколко часа след манипулацията и са много продължителни и обилни. Провокират се при минимални дразнения: хранене, говор, дори прием на течности. Много трудно се овладяват с локална хемостаза.
Лечението при такива състояния е базирано на принципа на заместващата терапия. Възможно е лечение чрез преливане на прясна кръв – тя съдържа всички хемостазни фактори, но за достигане на терапевтично ниво на дефицитния фактор се изискват 1.5 до 1.8 литра кръв. Това води до хиперволемия и дилатация на сърцето. Понастоящем масово приложение намира фракцията от криопреципитат – тя съдържа 4Е антихемофилен глобулин (фактор VIII на кръвосъсирването) в лиофилизиран вид за 1 мл. Съществуват и високо пречистени концентрати на фактор VIII – те съдържат 10 – 50 Е/мл. и се вливат венозно в терапевтична доза 20 – 30 мл. За лечение на хемофилия В се прилага комбиниран препарат – той съдържа фактори II, VII, IX и X в концентриран вид, но е силно ембологенен. Различните хеморагии изискват различно терапевтично ниво на антихемофилния глобулин – при екстракции – 25 – 30 % от нормата, при големи оперативни интервенции – до 70 %. Една единица фактор VIII / кг. тегло повишава плазменото му ниво с 2 %, а на фактор IX – с 1 %, т.е. за човек с маса 70 кг. се изискват 1015 единици фактор VIII и 2030 единици фактор IX за повишаване на плазменото им ниво от 1 до 30 %. При опасна за живота локализация на кръвоизлива се прави вливане на 25 – 30 Е/кг. и ежедневно се влива поддържаща доза от 12 – 15 Е/кг. При предстояща зъбна екстракция се прилага венозно РАМВА и се вливат 25 Е/кг. фактор VIII. След интервенцията се прилага венозно РАМВА три пъти дневно. Мускулните инжекции при хемофилици са строго забранени! При леки форми и профилактично може да се приложи ДДАВП (деамино-8Д-аргинин вазопресин) в доза 0,3 мкг/кг. венозно за стимулиране на синтеза на факторите.
Съществуват множество вродени коагулопатии, които се дължат на липса на различни фактори на кръвосъсирването. Те са много редки, но поставят значителна диагностична трудност и могат да доведат до хеморагии при интервенции в устната кухина и лицево - челюстната област. Такива са:
Хемофилия С (дефицит на фактор ХI) – тук обаче протичането е по-леко от хемофилия А и В
Дефицит на фактор ХII – болест на Hagemann
Дефицит на фактори II, V, VII и X
Хипо- и афибриногенемия. Всички изброени дотук заболявания са със сходна клинична картина и при всички тях се прилага заместващо лечение със съответните дози от липсващия фактор на кръвосъсирването
Дисфибриногенемии - това са характерна група болести с дефектна молекулна структура на фибриногена. Броят на патологичните фибриногени, открити досега, расте непрекъснато. Различните типове носят имената на градовете, в които са открити: има дисфибриногенемия тип Кливланд, Бетездо, Ню Йорк, Осло. У нас има описан случай от Лисичков.
Придобитите коагулопатии са с различна етиология. Недостатъчната резорбция на витамин К води до нарушения в кръвосъсирването. Характерен ранен симптом е кървенето при убождане (например при анестезия). Такова състояние се получава при заболявания на лигавицата на червата, при целиакия, спру, при механичен иктер вследствие туморно запушване или холелитиаза и нерядко при прием на антибиотици и сулфонамиди, които унищожават чревната флора. Коагулационни нарушения има при предозиране с орални антикоагуланти, а също и при чернодробни заболявания, тъй като черният дроб има основно участие в синтезата и метаболизма на коагулационните протеини. Синдромът на дисеминирана интравазална коагулация (ДИК – синдром) е придобита коагулопатия от преразходен тип. Получава се при разнообразни патологични състояния: отлепване на плацента, амнионна емболия, задържане на мъртъв плод, несъвместимо кръвопреливане, бластна левкоза, септични състояния, масивни тъканни увреждания, всички видове шок, гигантски хемангиоми, аортни аневризми, също при директно активиране на тромбинообразуването от протеолитични ензими – ухапване от змии, отравяне с гъби, остър панкреатит. При някои патологични състояния в лицево - челюстната област също е възможно развитието на ДИК – синдром – при инфекции, травми, алергични реакции и т.н. Клиничната картина е характерна, има остра и хронична форма. При острата симптомите са по-ярко изразени - по кожата се виждат големи суфузии, проникващи в дълбочина и сливащи се помежду си. Налице е обилно кървене от раневи повърхности и от места на убождане. Наред с това настъпват прояви на органна недостатъчност поради блокираната микроциркулация. Най-честа е белодробната инсуфициенция с цианоза, диспнея, белодробен едем. Наблюдава се и бъбречна недостатъчност с азотемия, анурия, има мозъчни преходни тромбози и гастроинтестинални хеморагии. Лечението се извършва в две направления: елиминиране на основния процес, отключил ДИК и лечение на хемостазните аномалии в резултат на самия ДИК. Провежда се заместващо лечение с антихемофилна плазма (богата на тромбоцити и фактори на кръвосъсирването), с прясна кръв (не повече от четири часа след вземането й поради образуването на спонтанни агрегати, които могат да блокират циркулацията), антихемофилен глобулин по 600 Е дневно, фибриноген – от 2 до 10 гр. дневно според нивото (критични нива са под 0.5 г/л). Успоредно с това се прилага антикоагулантно лечение с цел да се подтисне ексцесивното тромбообразуване. Влива се хепарин – 5000 – 10000 Е дневно при остър и 25 – 40000 Е дневно при хроничен ДИК – синдром. Ако има отворена ранева повърхност при острия ДИК, се изчаква няколко часа с прилагането на хепарина с цел да се отчете динамиката на хемостазата. При подостро протичане може да се приложат нискомолекулни хепаринови препарати – например фраксипарин 1 – 2 пъти дневно в доза 7500 – 15000 Е. Тези препарати имат и тромболитичен ефект. След овладяването на хеморагиите при остър ДИК – синдром настъпва реактивна хиперкоагулация, често водеща до белодробен дистрес и остра бъбречна недостатъчност; лечението продължава с постоянна инфузия на хепарин по 20000 – 30000 Е дневно за 7 – 10 дни.
Нарушения в кръвосъсирването се срещат и при пациенти, приемащи продължително орално кумаринови антикоагуланти (Syntrom, Syncumar – например при клапни протези). Такива пациенти се консултират с лекуващия ги интернист преди всяка хирургична манипулация. Обикновено се налага спиране на приема няколко дни преди интервенцията, след което приемът се възобновява.
Има кръвоизливи в резултат от причини от местен характер. Такива са:
Разкъсване на меки тъкани
Нараняване на кръвоносен съд от различен калибър
Фpaктypa на алвеола, алвеоларен гребен или на цялата челюстна кост
Неизкюретирана гранулационна тъкан или ocтанки oт кистозен caк
Вазодилатация на съдовете на алвеолата след преустановяването на действието на коригент съдържащите анестетици (рефлекторно преминаване от вазоконстрикция към вазодилатация)
Тумори на мекитe тъкани или косттa в зоната на eкстрахирания зъб (хемангиом, остеобластокластом)
При всички кръвоизливи се прилага лечение с цел да се спре изтичането на кръв и при по-голяма кръвозагуба – да се компенсира загубеното количество кръв. Ако причините за кръвоизлива са от общ характер, се лекува съответното общо заболяване по описаните при всяка нозологична единица методи. При причини от местен характер се установява етиологичният фактор и се елиминира неговото действие: изкюретирва се останалият гранулом или кистозен сак, заглажда се стърчащият костен ръб, зашиват се разкъсаните меки тъкани и т.н. Спирането на кръвотечението е временно и постоянно. Временното се осъществява чрез следните методи:
Дигитална компресия на мястото на увреждането – това се прави до създаване на условия за дефинитивна хемостаза
Дигитална компресия на избирателно място – на място, където захранващият съответната област кръвоносен съд може да бъде притиснат към кост и да се спре притокът на кръв към лезията. При кръвоизлив в областта на устната кухина ефект има притискането на a. carotis externa върху напречния израстък на VI шиен прешлен – той се проектира по средата на предния ръб на m. sternocleidomastoideus на нивото на пресичането му с хоризонталната линия между щитовидния хрущял и хиоидната кост
Компресивна превръзка. Поставят се няколко слоя стерилни марли върху кървящата екстракционна рана и пациентът стиска зъби. Възможно е да се изработят защитни пластинки от бързополимеризираща пластмаса с възможност за прикрепване към съседните зъби. Може да се постави компресивна превръзка, която притиска захранващ съд на проксимално място – за лицево - челюстната област това се постига чрез притискане на общата сънна артерия по способа на Каплан. Около шията откъм кървящата страна се увива бинт и се пристяга, като на противоположната страна пациентът вдига ръка и тя се омотава с бинта около шията – така не се притиска контралатералната обща сънна артерия и намалява опасността от мозъчна исхемия. Все пак главният мозък не може да се кръвоснабдява продължително време без участието на едната вътрешна каротидна артерия, ето защо на всеки 1,5 – 2 часа превръзката се отпуска до осигуряването на дефинитивна хемостаза.
Окончателното кръвоспиране се постига чрез:
Тампонада – алвеолата се тампонира плътно от дъното към повърхността. За целта се използват саморезорбируеми тампони (оксидирана целулоза) и хемостатични гъбички (Gelaspon). Тампонът от своя страна може да се напои с локални хемостатици (йодоформ, ЕАК, адреналин, кислородна вода)
Лигиране на мястото на увреждане – прошива се алвеолата на екстрахирания зъб
Лигиране на избирателно място – в редица случаи, когато се касае за по-голям съд с разположение на по-голяма дълбочина (например a. alveolaris inferior) и когато е невъзможно да се лигира на мястото на увреждането, се пристъпва към лигирането на проксимално разположено, по-подходящо за целта място. При кръвоизлив в резултат на зъбни екстракции се лигира a. carotis externa. Болният се поставя по гръб със силно отметната назад и в противоположната посока глава. По предния ръб на m. sternocleidomastoideus се прави разрез с дължина 6 – 7 см., който започва от нивото на ъгъла на долната челюст и преминава надолу. Послойно се срязват кожа, подкожната мастна тъкан и платизмата. V. jugularis interna се екартира или срязва между две лигатури. Срязва се и влагалището на m. sternocleidomastoideus и той се освобождава и екартира назад. Внимателно се разсича тънката задна стена на влагалището му, освобождава се v. facialis communis, която пресича косо оперативното поле и закрива артерията. След това вената се екартира нагоре или се срязва между две лигатури. На височината на горния край на щитовидния хрущял се намира бифуркацията на общата сънна артерия. Малко над това място, на около 1 – 1.5 см., се намира първото разклонение на a. carotis externa – a. thyroidea superior. Лигатурата се прави след отделянето на този първи клон. А. carotis externa е разположена външно и пред a.carotis interna – необходимо е голямо внимание и добра ориентация, за да не се лигира вътрешната сънна артерия!
Електрокоагулация на съдове – има добър ефект, особено при увреждане на по-малък по размер съд
Кръвоспиране с физични средства. Прилага се при дифузни капилярни кръвотечения. Апликацията на горещ физиологичен серум в раната предизвиква повърхностна коагулация на протеините и образуване на съсирек. Апликацията на лед предизвиква вазоконстрикция и също ограничава кръвоизлива
Кръвоспиране с химични средства – кислородна вода 3 и 6 %, екстракти от смрадлика и т.н.
Кръвоспиране с биохимични средства с местно действие. Прилагат се тромбин на прах (Velyn, Haemostop – T), суха плазма, сербацел, геласпон
Хемостаза с биохимични средства с общо действие. Прилагат се Reptilase – amp. 1 ml (екстракт от змийска отрова с отстранен невротоксичен компонент), Etamsylatum (Dicynone) – amp. 250 mg 2 ml, tab. 250 mg. Последният е синтетичен препарат, който подобрява адхезията на тромбоцитите към разкъсаната капилярна стена и скъсява времето на кървене. Добър ефект за укрепване на съдовете има комбинацията от Ca gluconici – amp 10 % 10 ml и vit. C – amp 5 или 10 ml венозно. Витамин К е необходим за синтеза на факторите на кръвосъсирването II, VII, IX и X в черния дроб. Прилага се венозно или парентерално най-често при кървене при предозиране с кумаринови антикоагуланти – те подтискат синтеза на коагулационните фактори в черния дроб. Използват се таблетки 15 мг., и ампули 10 мг/1мл. Ефектът се проявява след 6 – 7 часа и продължава 24 часа.
Друга група хемостатични средства с общо действие са инхибиторите на фибринолизата. Те подтискат образуването на плазмин или блокират действието му. Тук спада епсилон-аминокапроновата киселина. Тя е структурен аналог на лизина, конкурентно блокира действието на плазмина и плазминогеновите активатори, които се свързват с лизиновите остатъци – нарушава се фибринолизата. ЕАК се прилага в ампули 40 % 10 мл. Същият механизъм на действие има и парааминобензоената киселина (РАМВА) – амп. 1% 5 мл., табл. 250 мг. Aprotinin (Contrical) е естествен протеазен инхибитор с антиплазминови, антитромбинови, антитрипсинови, антихемотрипсинови и антикаликреинови свойства. Прилага се в сухи ампули 100000 и 500000 антитромбинови единици. За антифибринолитична терапия се прилагат 40000 – 100000 Е дневно; профилактично са достатъчни 10 – 20 % от тази доза. Прилага се предимно като венозна инфузия.
При кръвозагуба над 500 мл. се налага компенсиране чрез инфузия. За целта се използват обемнозаместващи разтвори или прясна едногрупова кръв. Обемнозаместващи разтвори са физиологичният разтвор (0,9 % р-р на натриев хлорид), 5 % р-р на глюкоза, Рингеров разтвор и колоидни разтвори като хемодекс, декстран 70, декстран 40 и др. Ако след инфузия на 500 – 1000 мл. обемнозаместващ разтвор артериалното налягане не се нормализира, се предприема инфузия на кръв. След вливане на 1000 мл. типът на разтвора се сменя. Общо не бива да се влива повече от 2000 – 3000 мл. разтвор за период от 24 часа.
При нужда от кръвопреливане трябва да се определи кръвногруповата принадлежност на кръвта от банката и на болния с тест – серуми. След това се прави директна проба in vitro, последна е биологичната проба – in vivo. При нея наконечникът на тръбичката от системата (вече изпълнена с кръвта от банката) се съединява с иглата във вената на болния. Вкарват се струйно 15 – 20 мл. кръв и след това се ограничава вливането до съвсем бавна капка. Ако до 10 – 20 мин. болният не получи болки в кръста, затруднено дишане, главоболие, гадене, повръщане, изпотяване, зачервяване, т.е. белези на кръвногрупова несъвместимост, отново се вливат струйно 10 мл. кръв. Ако и след второто струйно вливане болният няма оплаквания, кръвопреливането се осъществява докрай. Хемотрансфузията е най-сигурното и ефективно средство за компенсация на кръвозагуба, особено ако последната е с по-голям обем.