От най-дълбока древност медицината си поставя за цел да лекува туморите - да ги ликвидира дефинитивно и пациентът да се смята за трайно изелкуван или поне да се удължи животът му и доколкото е възможно, да се подобри качеството на живот на онкоболния. Лечението на доброкачествените тумори рядко представлява трудност от терапевтична гледна точка - в повечето случаи е достатъчна една ексцизия в здраво и процесът е ликвидиран. В редки случаи има и алтернативни методи на лечение - алкохолизация на хемангиомите, криодеструкция на различни кожни доброкачествени лезии и т.н. Лечението на злокачествените тумори обаче все още представлява едно истинско предизвикателство и в много случаи е голяма трудност, изискваща мултидисциплинарен подход, тъй като малигненият процес представлява нещо доста сложно от биологична гледна точка и има своя специфика в много отношения. Най-общо в медицината се прилагат три типа лечения - етиологично, патогенетично и симптоматично; при лечението на малигнените тумори и трите метода намират широко приложение и нерядко се прилагат в комплект. Поради спецификата на туморния растеж (възникване и самоподдържане с рядка възможност за спонтанна регресия) етиологичното лечение се прилага рядко - с премахване на фактора, който предизвиква туморния растеж, малигненият процес не изчезва за разлика от възпалителните процеси например. Патогенетичното лечение намира доста широко приложение - повечето химиотерапевтици въздействат именно върху механизма, по който се развива патологичният процес, при което този механизъм се прекъсва и имунната система и регенративните способности на организма водят до трайно излекуване на неоплазията. Симптоматично лечение се прилага почти винаги - всеки малигнен процес представлява тежка патология, съпроводена с редица симптоми, изискващи комплексно лечение.
Лечението на злокачествените тумори в устната кухина и лицево – челюстната област на съвременния етап от развитието на медицината се извършва по различни методи: хирургично, лъчево и химиотерапевтично; допълнителни методи са имунотерапията и фотодинамичният метод за лечение. По показания могат да се прилагат различни комбинации от тези методи: хирургично и лъчелечение, лъче- и химиолечение, хирургично, лъчево и химиотерапевтично лечение.
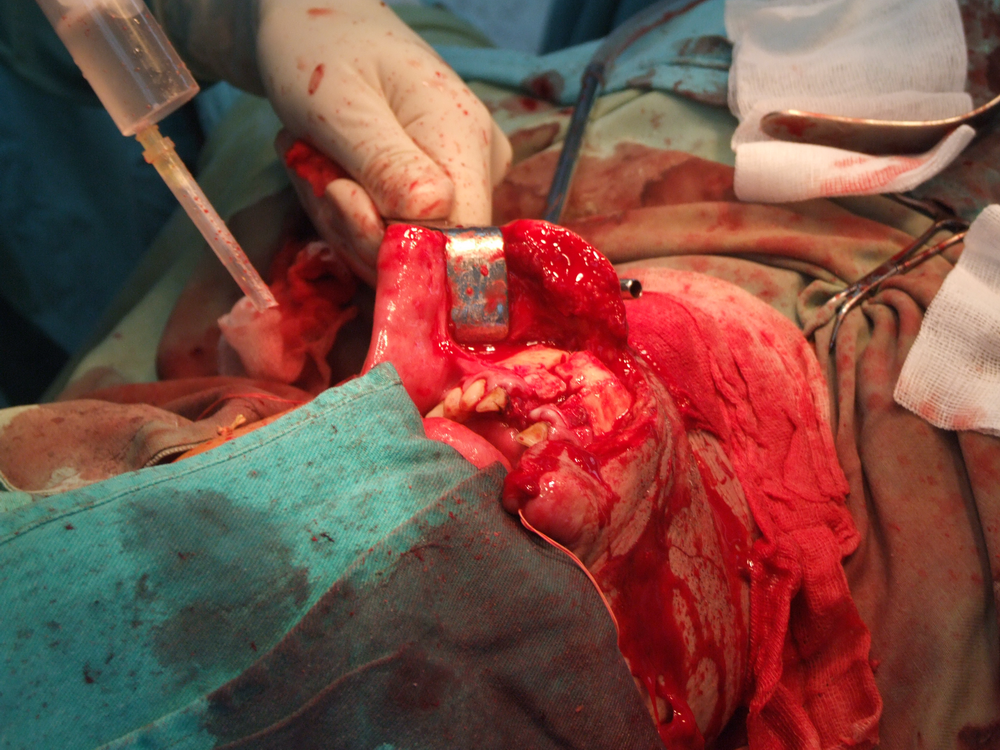
Хирургичното лечение продължава в повечето случаи да бъде основно лечебно мероприятие при туморите в лицево – челюстната област. То е винаги свързано с пре- или интраоперативното извършване на биопсия. Биопсията е хирургичен метод, който означава взимане на материал за хистологично изследване. В зависимост от клиничната ситуация се провежда инцизионна или ексцизионна биопсия. Инцизионната се състои във вземане на фрагмент от тумора с размери обикновено 1 / 1 см. от границата между неопластичния процес и здравите тъкани (това се прави с цел при хистологичното изледване да се види добре разликата между тях). Тук има известно противоречие с принципите на абластиката и антибластиката, а в някои случаи е възможно и в резултат на инцизионна биопсия да се стигне до ускоряване на туморния растеж. Впоследствие в зависимост от резултата от биопсията се определя най-подходящият метод за лечение.
www.dentalimplants.bg Ахроматичен невус www.bg-dentist.com Себацеен аденом www.omegadentagroup.net
Ако желаете безплатен преглед при лицево - челюстен хирург, запазете си час на телефон 032 642056
Отговаряме и на запитвания по електронна поща на адрес ralev@dentist.bg и ralev@ralev-dental.bg
Лицево - челюстна хирургия Зъбни импланти Базални импланти Местна анестезия Обща характеристика на туморите
При ексцизионната биопсия пък се отстранява целият тумор. Това е възможно само при по-малки по размер тумори и при тумори в области, където не би се стигнало до тежки функционални и козметични нарушения. Ако се знае със сигурност, че туморът е доброкачествен, се извършва щадяща оперативна интервенция с по-добри естетични и функционални резултати. Ето защо за всеки клиничен случай е необходимо да се прецени как би било по-добре да се процедира в зависимост от локализацията и биологичното поведение на тумора.
В някои случаи при започване на операцията на един доброкачествен тумор в дълбочина се откриват белези на злокачествен растеж. Тогава е необходимо интраоперативно да се реши обемът на интервенцията, поради което се изготвя т. нар. гефрир (от нем. gefrieren – замръзвам). Това е препарат, който се приготвя бързо чрез замразяване на тъканите и служи за поставяне на хистологична диагноза. Образът при такива препарати обаче не винаги е достатъчно качествен – понякога картината се замъглява. Затова в днешно време този метод се използва по-рядко, но все още не загубил своето значение. Лоши са резултатите от гефрирно изследване на лимфен възел - при замразяването възелът се разрушава и структурата му става неразпознаваема при микроскопско изследване. Освен това възелът е с малък размер, трудно може да се нареже на части, някои от които да се използват за изготвяне на траен препарат и такъв не може да се изготви. Поради това много често при подаване на лимфен възел за гефрирно изследване патолозите предварително вземат отпечатък от структурата му с предметно стъкло, след което изготвят гефрир.
При тумори в областта на шията или слюнчените жлези се използва аспирационна биопсия – тя се извършва с конструирани за целта спринцовки с последващо цитологично изследване. Методът е по-малко инвазивен, но цитологичното изследване не е толкова показателно колкото хистологичното.
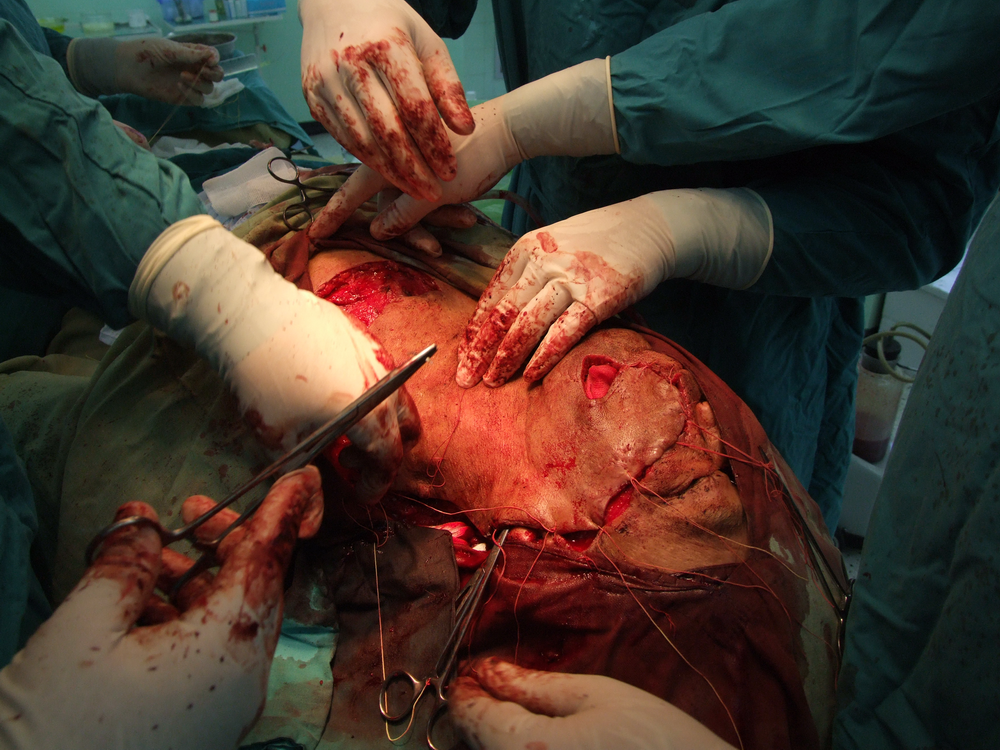
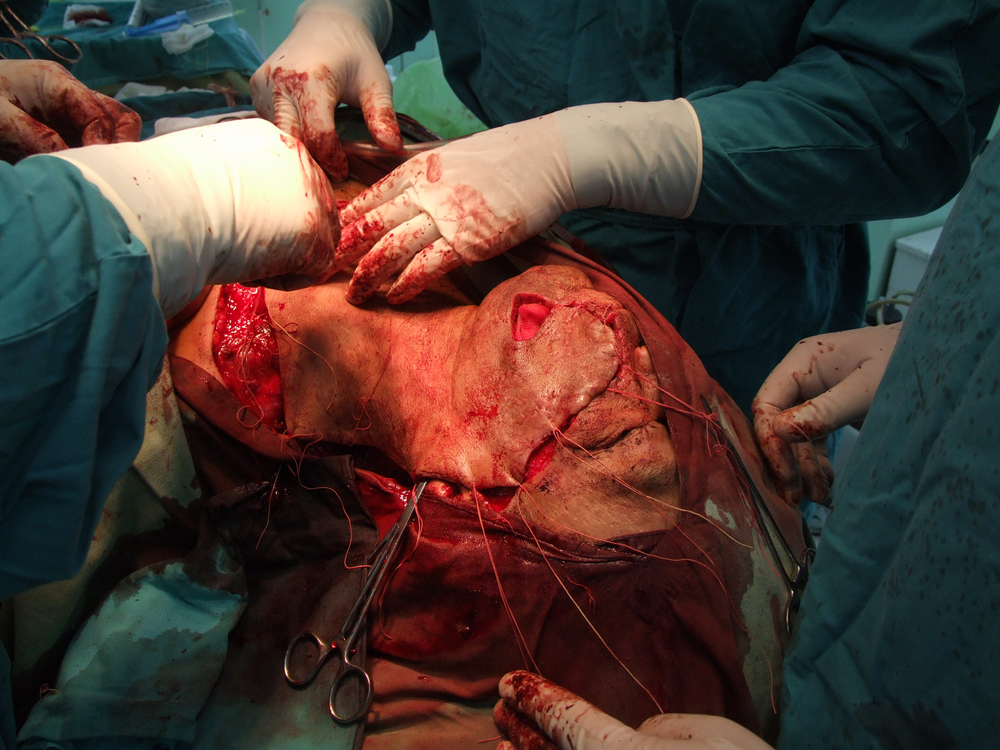
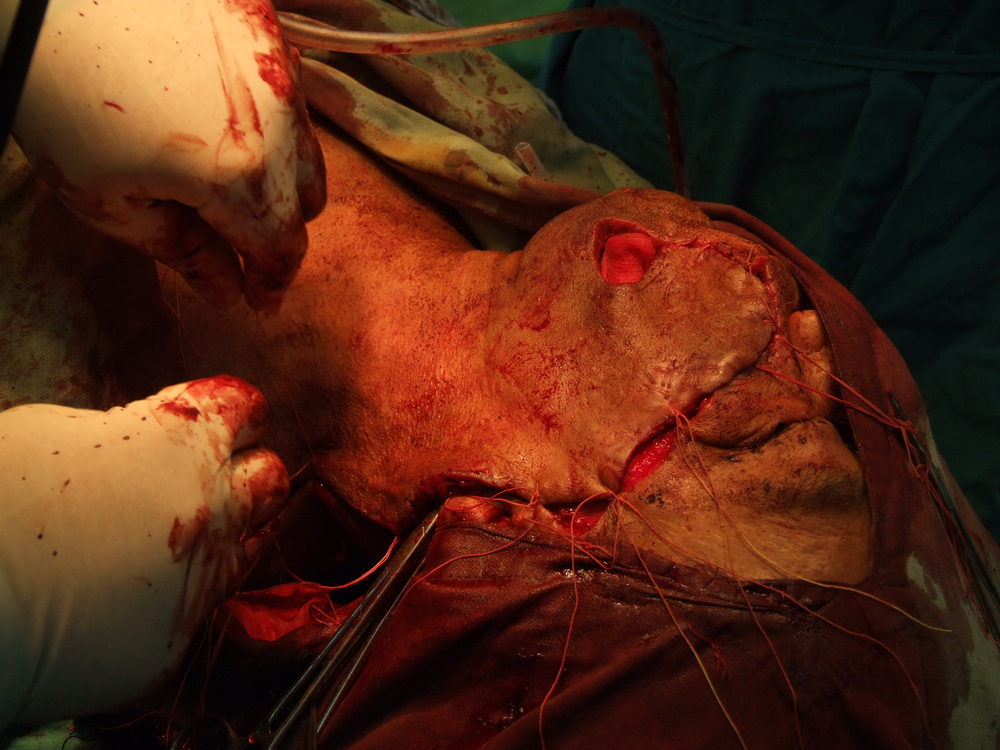
Основните моменти, свързани с ефективността на хирургичното лечение, са два – ранна оперативна намеса и радикалност на оперативната интервенция. Ранната намеса означава че трябва да се оперира веднага щом се постави диагнозата – колкото по-малък е туморът, толкова по-добри са условията за качествено извършване на операцията, съответно и лечебните резултати. Извършване на радикална оперативна намеса означава, че туморът трябва да бъде отстранен с част от околните здрави тъкани – всеки компромис с този основен принцип води до повишаване на опасността от развитие на местни рецидиви или далечни метастази. Изрязва се на разстояние най-малко 1 – 1,5 см. в здрави тъкани от видимите граници на злокачествения тумор. Изисква се и да се спазват принципите на абластиката и антибластиката с цел да не се допусне осеменяването на околните здрави тъкани с неопластични клетки. Работи се внимателно, не се докосват околните тъкани с инструменти, с които вече е докосван туморът. Операторът през цялото време на интервенцията трябва да се стреми към минимално травматизиране на тъканите. Използването на електронож и коагулатор възпрепятства попадането на туморни клетки в кръвния ток, независимо че заздравяването на оперативната рана първично може да бъде затруднено.
По отношение на рецидивите голямо значение има радикалността на първоначалната оперативна интервенция. В последните години започват да навлизат методи за определяне на границите на тумора, които подпомагат хирурга при първоначалното отстраняване. Голямо приложение намират компютърната томография и ядрено - магнитният резонанс. Това обаче са само помощни методи - те не успяват да различат нормалната от неопластичната тъкан и са само спомагателни. Ядрено - магнитният резонанс осигурява отличен образ в областта на меките тъкани; компютърната томография е надеждна за диагностика на състоянието на костните тъкани, въпреки че различни дентални композитни възстановявания, зъбни импланти и металокерамични протезни конструкции понякога влошават качеството на образа.
Позитронно - емисионната томография (РЕТ - скенер) е сравнително нов метод, който дава възможност за разграничаване между нормалната и туморно променената тъкан. При нея се използва флуор-2-дезокси-D-глюкоза. С помощта на този метод се визуализират така наречените хиперметаболитни зони - зони, в които е налице повишена обмяна на веществата, което се наблюдава при тумори и възпалителни процеси. Приликата на един туморен процес с едно възпаление може понякога да доведе до диагностични трудности, поради което не е удачно данните от РЕТ-скенера да се интерпретират самостоятелно, а е добре да се съпоставят с други методи на изследване, поне клиничен преглед. Освен това РЕТ-скенерът не осигурява надежден образ на анатомичните структури - те изгледжат само грубо очертани, поради което всички производители на апаратура се опитват да комбинират РЕТ-скенера с компютърен томограф, като се правят опити да се наслагват двете образни изследвания чисто софтуерно. Гоялмо предимство на РЕТ-скенера е възможността да се откриват некротични огнища в центъра на тумора - те се представят като хипометаболитни зони. Това обаче е възможно само при лезии, които са с по-голям размер, тъй като разделителната способност на сензорите на РЕТ-скенера не е голяма. Към момента разделителната способност на различните апарати е в размер от порядъка на 4 - 6 милиметра.
Важен е и редовният следоперативен контрол – с него своевременно се откриват рецидивите и се дава възможност за ранна допълнителна оперативна интервенция или лъчелечение. По отношение на диагностиката на рецидивите РЕТ-скенерът също има решаващо значение - ако се открие хиперметаболитна зона на мястото на прекарана оперативна интервенция преди време, то със сигурност се касае за рецидив на злокачествения тумор. РЕТ-скенерът също така успешно открива далечни метастази, особено в областта на белия дроб, който е труднодостъпен за конвенционални изследвания, а другите образни изследвания не са толкова информативни.

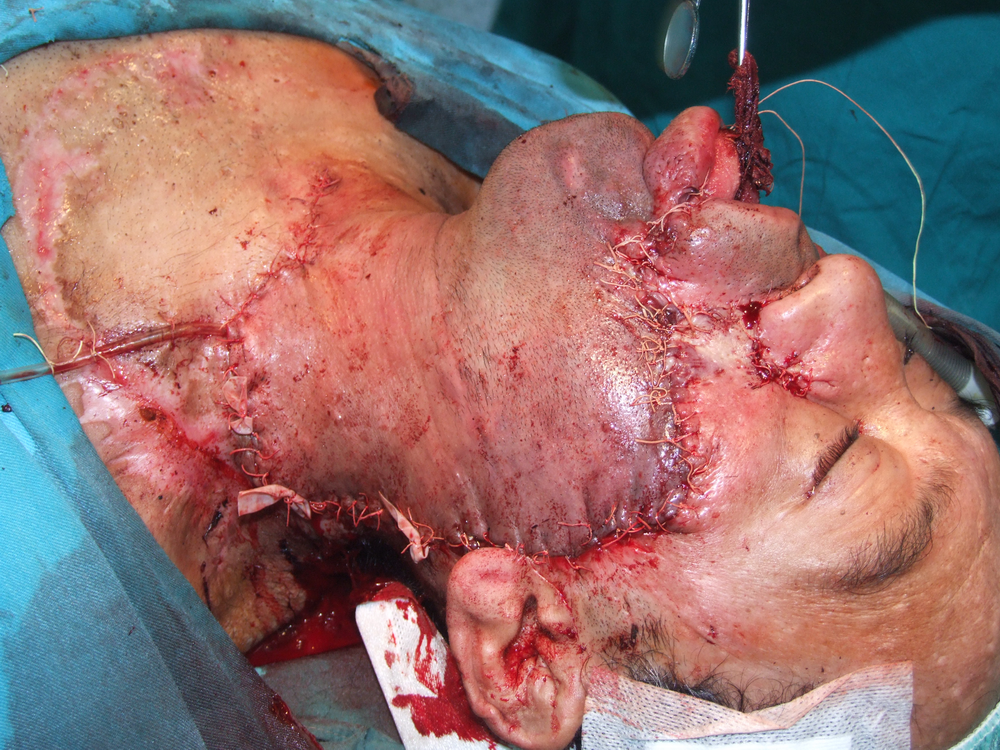
Карцином на пода на устната кухина
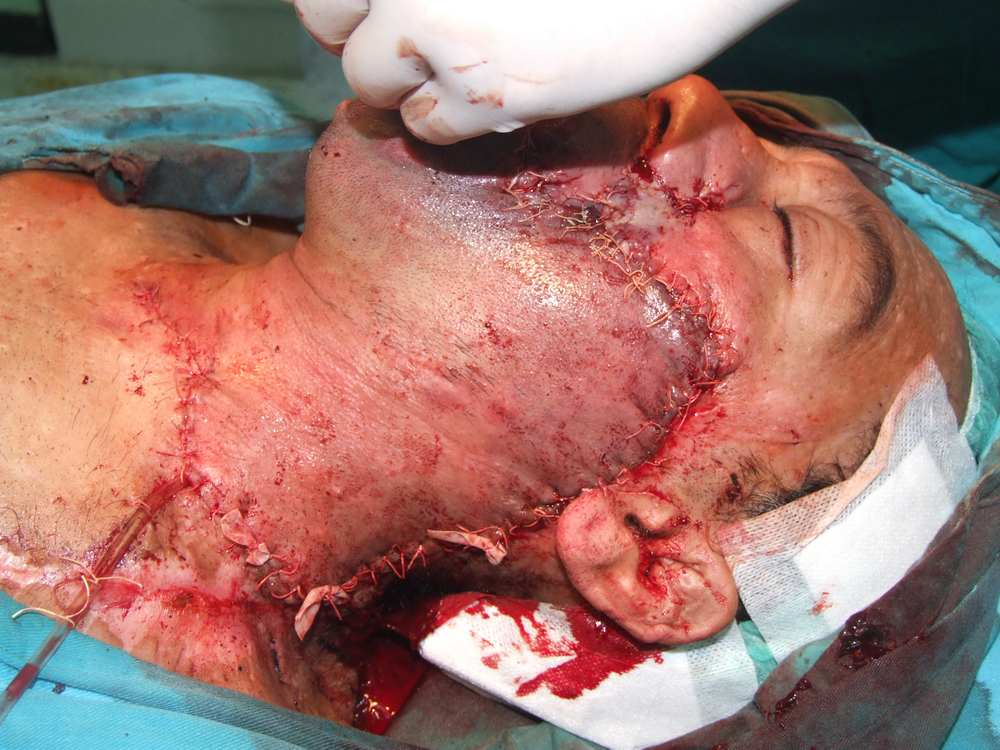
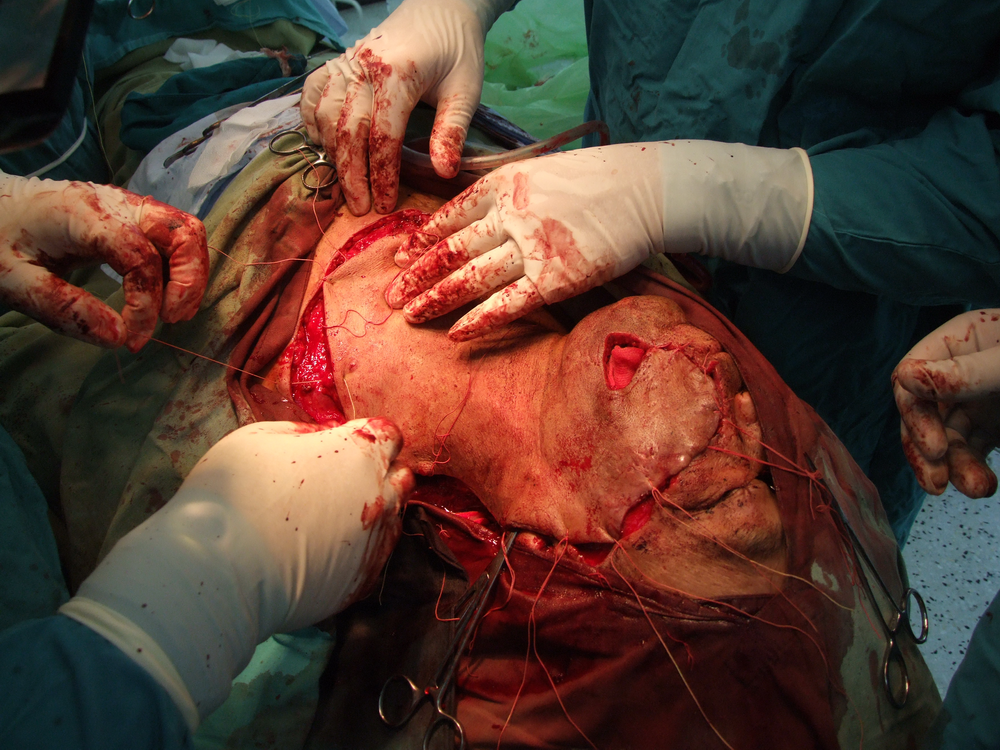
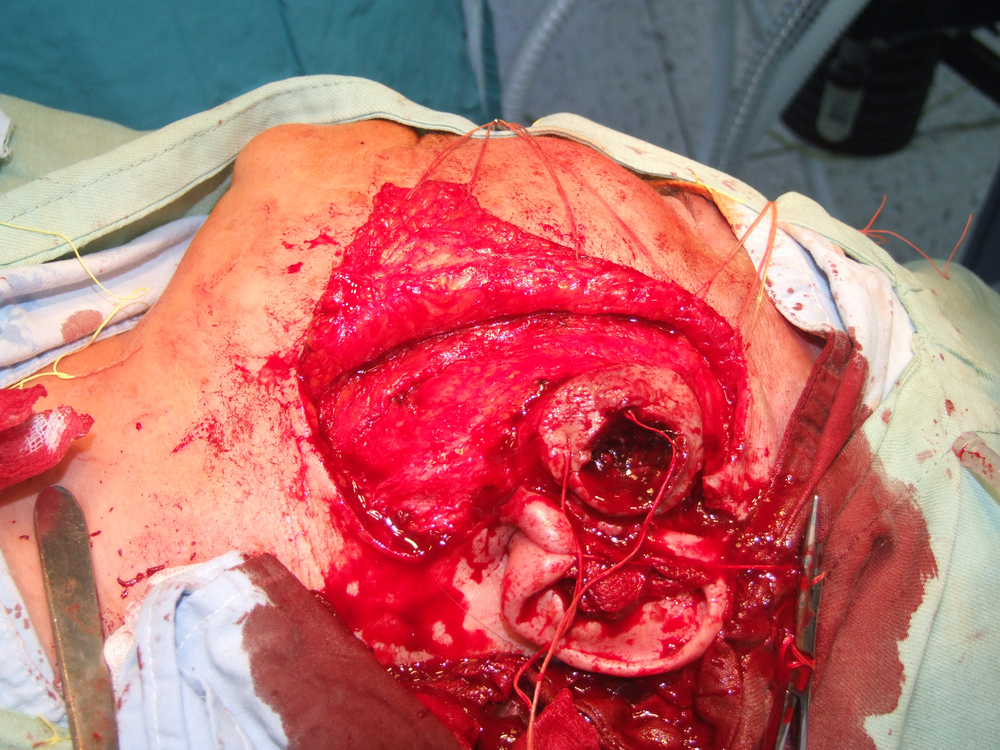
Лъчелечението е метод, при който с помощта на йонизиращи лъчения се унищожават туморните клетки. За механизма на това въздействие има изградени две теории – мишенна и теория на непрякото действие. Според мишенната теория йонизиращата частица се сблъсква с жизненоважен център в клетката, разрушава го и клетката загива. Според теорията за непрякото действие пък лъчението предизвиква радиолиза на водата и други химични промени – в резултат на това се получават силно реактивоспособни химични радикали, които увреждат редица клетъчни структури и отново се стига до смърт на клетката.
Лъчечувствителността на тъканите към йонизиращите лъчения е различна и е правопропорционална на репродуктивната активност на клетката, на периода на митозата й и обратнопропорционална на морфологичната и функционална диференциация на клетката. От различните тумори най-лъчечувствителни са лимфоретикуларните тумори и недиференцираните карциноми, след това спиноцелуларните карциноми и най-слабо – аденокарциномите, меланомите и саркомите.
Най-общо лъчелечението се класифицира по следния начин:
I. Според вида на лъчите
фотонни – рентгенотерапия, телегаматерапия и спирачно лъчение от линеен ускорител
корпускулярни – електронотерапия (бета – терапия), протонотерапия, неутронотерапия
II. Според източника на йонизиращото лъчение – рентгенов апарат, радиоактивно вещество или ускорител на частици
III. Според разположението на източника спрямо тялото на болния
перкутанна лъчетерапия – разстоянието от източника до тялото на пациента е 0.5 см.
близкодистанцирана лъчетерапия – разстояние 0.5 – 5 см.
далечнодистанцирана – разстояние над 30 см.
вътрекухинна – източникът е поставен в естествени кухини – устна кухина, матка, пикочен мехур, ректум
вътретъканна – чрез заигляне с радиоактивни игли, най често на езика, устните, пода на устната кухина
метаболитна – въвеждане на радиоактивни вещества, които се натрупват избирателно в дадени тъкани и органи – например I131 в щитовидната жлеза
IV. Според размера на облъчвания обем
малък – участък от кожата, език, долна устна
ограничен – устна кухина
голям – цяло тяло
V. Според разпределението на дозата в пространството
еднополно – използва се директно поле при повърхностно разположени тумори
двуполно и чрез насрещни полета (тунел) – с широко приложение при тумори на устните, бузите, езика, пода на устната кухина
многополно (кръстосан огън) – при по-дълбоко разположени тумори с цел предпазване на околните тъкани
тангентно – при повърхностни тумори, също с цел предпазване на подлежащите тъкани. Намира широко приложение при тумори на гърдата
облъчване с решетки и фигурирани полета. Решетката оставя острови от запазена тъкан след облъчване, която ускорява заздравителния процес. При облъчване с фигурирани полета се поставят оловни блокове, които предпазват важни органи от увреждане
облъчване с ротация – апаратът се върти около тялото на болния
облъчване по определена крива, предварително зададена и очертана по тялото на болния
махаловидно облъчване – така се облъчва хомогенно повърхностен слой от тялото
облъчване с намаляване на полето – ограничаване на площта на облъчване с всеки сеанс. Така се повишава дозата където е необходимо (например при персистиращ лимфен възел) и се предпазват в същото време околните здрави тъкани
VI. Разпределение на дозата във времето – еднократно, двукратно или многократно
VII. Според големината на единичната доза
суперфракционирано – 2 пъти по 1 грей дневно
дребнофракционирано – 2 гр. дневно
среднофракционирано – по 4 гр. дневно
едрофракционирано – по 5 или 6 гр. дневно
крупнофракционирано – по 8.5 – 10 гр. дневно
VIII. Според поставената крайна цел
радикално – с цел пълно и трайно излекуване на пациента. Облъчването е многократно дребно или суперфракционирано
палиативно – с цел намаляване на размера на тумора и удължаване на живота на пациента. Прави се при увредени болни, в късни стадии и неиздържани в онкологично отношение операции. Облъчването е среднофракционирано
симптоматично – с цел да се предотвратят някои от тежките съпровождащи тумора симптоми – кръвоизливи, болка и т.н. Провежда се при болни в най-напреднали стадии, облъчването е еднократно или двукратно, едро- или крупнофракционирано
IX. Според времето на облъчване спрямо оперативната интервенция
предоперативно – с цел намаляване на размера на тумора, тромбозиране на съдовете, намаляване на възможността за метастази и ограничаване на възпалителния вал около тумора
интраоперативно – поставяне по време на интервенцията на радиоактивни игли в самия тумор или регионерния лимфен басейн
следоперативно – с цел унищожаване на останали туморни тъкани или отделни клетки, имплантирани по време на работа в оперативното поле.
Противопоказания за лъчелечение са тежко общо състояние на пациента, нарушена хемопоеза, увреждания на паренхимни органи (черен дроб, бъбреци), сърдечна недостатъчност, инфекциозни заболявания (грип, ангини), изострени хронични заболявания. Поради значителната разлика в чувствителността на различните клетки, тъкани и органи лъчетерапията предизвиква унищожаване не само на туморните, но и на околните здрави тъкани. При това се получават лъчеви реакции – изменения, които в следващите две – три седмици след лъчелечението преминават без съществено лечение. Лъчевите увреждания обаче представляват органични и функционални промени на тъканите, които изискват специално лечение. Срещат се местни и общи лъчеви реакции и увреждания.
Местните лъчеви реакции се класифицират по следния начин:
I. На кожата на лицето и шията:
еритем. Настъпва при доза 20 – 30 Gy, налице е болезненост при палпация. Епилира се кожата на брадата или косата в окципиталната област
сух радиодерматит. Настъпва при доза 40 – 50 Gy, епителът леко се залющва и е налице умерен оток
влажен радиодерматит. Получава се след доза 60 – 70 Gy. Понякога се образуват везикули, а понякога мокрещи повърхности с яркорозов цвят, към които лесно се наслагва допълнителна инфекция. Винаги е налице болезненост
II. На лигавицата на устната кухина се формира начален радиоепителиит, който протича в три степени:
начална – с наличие на хиперемия на лигавицата и изразен оток
втора степен – лигавицата е изгладена, бледа и плътна, без блясък, налице е болезненост при хранене. Променят се вкусовите усещания, има ксеростомия
трета степен – има десквамация на епитела, ерозии с мръсни некротични налепи. Лигавицата е оточна, суха и ярко зачервена. При продължаване на лъчелечението огнищата се сливат и се образува дифузен ерозивен радиоепителиит. Налице е силна болезненост, нарушени са движенията на езика, говорът и храненето
Най-честите общи лъчеви реакции са левкопенията и тромбоцитопенията. След спиране на лъчелечението те преминават бързо. Често се наблюдават главоболие, сънливост, емоционална неустойчивост, полиурия, загуба на апетит и тегло, гадене, повръщане.
Местните лъчеви увреждания са няколко групи:
На кожата и лигавиците – те биват ранни и късни. Ранните ангажират високочувствителните и бързо регенериращи структури (например покривния епител). Късни увреждания са атрофичният и хипертрофичен епителиит и дерматит, лъчевата фиброза, лъчевата язва и лъчевият рак. При правилно проведено лъчелечение те са много редки
На костите – лъчев остеомиелит с последваща остеорадионекроза. Най-често е засегната долната челюст. Началото е остро, има изразена болезненост, левкоцитоза и повишена температура. Образуват се надкостни абсцеси и фистули с последваща секвестрация. Гингивата некротизира, оголват се различно големи участъци от костта. При инфектирането им те стават силно болезнени. Понякога процесът започва с изпадане на здрави зъби. Чести са спонтанните фрактури. Рентгенологично се наблюдават единични или множествени огнища на деструкция на костната тъкан с неравни и нерезки контури и костни секвестри в центъра. Понякога тези секвестри се отделят самостоятелно и след това започва бързо възстановяване на болния. В противен случай е необходимо те да се отстранят заедно с гранулационната тъкан. На болния се дават остеотропни антибиотици, аналгетици, витамини и щитовидни хормони. Хипербарната оксигенация стимулира фибробластната пролиферация към центъра на огнището
На зъбите – те стават светлосиви или черносиви, емайлът загубва блясъка си и става трошлив. Понякога се открива дебел трудно отделящ се налеп. Намалява твърдостта на зъбните тъкани. Развива се лъчев кариес, който е дифузен и с атипична локализация. Пулпата изпада в некробиоза, поради което в челюстите се развиват тежки възпалителни процеси.
Общите лъчеви увреждания са от типа на острата или хронична лъчева болест и са изключително редки поради дозите, които се прилагат при лъчелечението на злокачествените тумори на устната кухина и лицево - челюстната област.
Химиотерапията е метод за лечение на туморите със специфични лекарствени средства. Цели се унищожаване на туморните клетки не само в първичното огнище, но и на микро- и макрометастазите в целия организъм. При провеждането на химиотерапия важно значение имат видът на тумора и неговото разпространение и общото състояние на организма. Най-чувствителни са лимфомите, а най-резистентни – саркомите. Недиференцираните тумори имат по-висок митотичен и метастатичен потенциал, по-интензивен растеж, съответно и по-висока чувствителност спрямо химиотерапия. Метастазите са по-чувствителни от първичния тумор, а ефектът от лечението е обратнопропорционален на тяхната големина и на големината на първичното огнище. Клетъчният цикъл на делене също има значение – най-чувствителни са клетките през фаза S на митотичния цикъл, когато се извършва активиране на процесите на синтез и подготовка за следващо делене. Така химиотерапевтиците най-общо въздействат като подтискат пролиферацията на клетките, нарушават процеса на делението им, пречат на синтеза на ДНК и РНК, т.е. съществуват три ефекта от приложението на химиотерапевтици – цитостатичен, цитотоксичен и мутагенен.
Прилагането на противотуморните препарати може да се осъществи перорално, локално (чрез унгвенти и разтвори) и инжекционно (венозно, мускулно, субкутанно, интраартериално или интракавитарно). По-често химиотерапията е обща – при перорално, подкожно, мускулно, венозно, ректално и вагинално приложение. При регионалната химиотерапия се въздейства върху тумори с повишена концентрация на препарата – това става при канюлиране на съответни приводящи артерии и инфузионно въвеждане на препарата през канюлата. За първи път е приложена през 1954 г. от Sullivan и сътр. Предимствата й са по-голяма концентрация на цитостатика в областта на тумора, продължителният контакт между цитостатика и тумора, намаляването на токсичността върху целия организъм. Канюлира се съответният клон на a. carotis externa. Предпочита се фракционираното продължително приложение на химиотерапевтици в интервал от 1 – 3 часа и въвеждане на ударни дози в интервали от 2 – 3 дни. Противопоказания за интраартериална инфузионна химиотерапия са наличието на регионерни или далечни метастази, изразена лъчева реакция или лъчеви усложнения, генерализирана атеросклероза, сърдечно – съдови усложнения, увредено общо състояние.
При тумори в лицево – челюстната област химиотерапията рядко се провежда самостоятелно – почти винаги се съчетава с хирургично или лъчелечение. Монохимиотерапията се състои в приложение само на един препарат. В днешно време обаче много по-често се прилага полихимиотерапия – комбинации от няколко препарата с доказан терапевтичен ефект при съответния тумор.
Неоадювантна химиотерапия е химиотерапия, която се прилага преди всякакво друго лечение. Смята се че по този начин се увеличава ефикасността – туморът преди операцията е с интензивен растеж и обмяна, добра васкуларизация, липсват постоперативни тромбози на съдове и цикатрикси. Същевременно се намалява размерът му, съответно обемът на оперативната интервенция или обемът на облъчване при лъчелечение.
Когато химиотерапията е само допълнение към останалите методи на лечение с цел повлияване на метастазите и предотвратяване на рецидивите, се говори за адювантна химиотерапия. Палиативната химиотерапия пък не се стреми към пълно излекуване, а само към намаляване на размера на тумора и подобряване на качеството на живот на пациента.
Противотуморните средства се разделят най-общо по химичен строеж и механизъм на действие по следния начин:
I. Алкилиращи – заместват водороден атом в дадено съединение с алкилна група. Тук влизат няколко подгрупи противотуморни средства:
хлоретиламини – циклофосфамид, халоксан, ембихим, хлорбутин
етиленимини – тиофосфамид
алкилсулфонати
епоксиди
производни на нитрозуреята
триазени
производни на платината – цисплатинум, платинол, биоцисплатинум
II. Антиметаболити – структурни аналози или функционални антагонисти на важни клетъчни метаболити:
антагонисти на фолиевата киселина – метотрексат
антагонисти на пиримидина – 5-фторурацил, цитарабин
антагонисти на пурина – 6-меркаптопурин
III. Растителни вещества – алкалоиди и глюкозиди, които унищожават клетката предимно в метафазата от цикъла на клетъчното делене. Освен това те уеднаквяват дележните цикли на всички неопластични клетки, те започват да се делят едновременно и по този начин стават по-податливи на въздействието на останалите химиотерапевтици. Тук влизат:
алкалоиди на Vinca rosea – винбластин и винкристин
производни на Colhicium automnale – колхамин
производни на подофилина – етопозид
IV. Антибиотици с противотуморно действие, които се получават от някои микроорганизми
актиномицини – актиномицин Д
антрациклини – адриамицин, фарморубицин, рубомицин
други – блеомицин, който намира широко приложение в химиотерапията на туморите на устната кухина благодарение на разработките на катедрата по ЛЧХ към ВМИ – Пловдив
V. Хормони – най-често кортикостероиди – преднизолон, целестон и др.
VI. Имунотерапия. Според някои съвременни автори това се разглежда като напълно самостоятелен метод за лечение на неопластични процеси. Според други имунотерапията на практика е подвид на химиотерапията, тъй като и при нея се въздейства върху тумора с медикаменти. Различен е единствено механизмът на въздействието. Използват се няколко вида имунотерапия:
активна специфична – чрез ваксини, създадени от обработени туморни клетки. Методът засега се прилага най-вече експериментално
активна неспецифична – чрез ваксини (най-вече БЦЖ), чрез които се цели да се подобри общата имунна реактивност на организма. Приложение намират интерфероните и някои други неспецифични имуностимулатори – лентинан, пахцибанил
пасивна серо- и лимфоцитотерапия. Ефикасен метод е приложението на противотуморни антитела, свързани с молекула химиотерапевтик – така медикаментът достига директно до туморната клетка
пасивна имунотерапия с продукти на имунокомпетентни клетки
комбинирана имунотерапия
Лечението с химиотерапия се прилага по различни показания при туморите на устната кухина и лицево - челюстната област. При карциномите то се прилага главно в съчетание с хирургично лечение с цел унищожаване на останали туморни клетки. В късните иноперабилни стадии химиотерапията се прилага в комбинация с лъчетерапия или по-рядко самостоятелно с палиативна цел.
Монотерапията е най-често с метотрексат или блеомицин. Метотрексатът се прилага първоначално в доза 10 mg венозно, мускулно или перорално, през първите дни ежедневно, а по-късно през ден до обща курсова доза 150 – 220 мг. Блеомицин се прилага се и.в., като първата апликация е от 15 мг. (1 флакон) и слел това при при добра поносимост 30 мг. – 2 или 3 пъти седмично в курсови дози по 300 мг.
За полихимиотерапия при карциноми се прилагат различни схеми, най-честите от които са:
Метотрексат 50 mg/m2 1 и 7 ден + 5-фторурацил 500 mg/m2 1 и 7 ден с левковорин, всички медикаменти венозно
Платинол 60 mg/m2 1 ден + 5-фторурацил 600 mg/m2 венозно от 2 до 5 ден
Циспалтина 25 mg/m2 + 5-фторурацил 500 mg/m2 от 1 до 5 ден
Метотрексат 120 mg/m2 1 ден + цисплатина 100 mg/m2 1 ден 6 часа след метотрексата + 5-фторурацил 1000 mg/m2 от 2 до 5 ден
При Ходжкинови лимфоми полихимиотерапията е основен метод на лечение. Широко прилагана е схемата MOPP:
Nitrogen mustard 6 mg/m2 телесна повърхност венозно 1 и 8 ден
Vincristin (Oncovin) 1,4 mg/m2 венозно първи и осми ден
Procarbasine 100 mg/m2 перорално от първи до четиринадесети ден
Prednisone 40 mg/m2 перорално от първи до четиринадесети ден.
При неходжкиновите лимфоми една от широко прилаганите схеми е схемата СНОР:
циклофосфамид 600 mg/m2 първи и осми ден
хидроксирубицин (адриамицин) – 25 mg/m2 пьрви и осми ден
винкристин (онковин) – 1,4 mg/m2 първи и осми ден
преднизон – 40 mg/m2 от пьрви дo осми ден
Противопоказанията за химиотерапия са същите както тези за лъчелечение. Освен това химиотерапия не се прилага до 1 месец след края на лъчелечението.
Фотодинамичният метод се използва за диагностика и лечение на злокачествени тумори. В организма се инжектират съединения, които имат свойството избирателно да се натрупват в раковата клетка. При облъчването им с лазер те започват да флуоресцират, като по този начин показват мястото на тумора. След облъчване с друга дължина на вълната в поразената клетка започват биохимични промени, които водят до нейното унищожаване. Методът е безвреден за болните, сравнително евтин и може да се използва заедно с другите методи за лечение на туморите.